|
4 アミノ酸h
【アミノ酸】
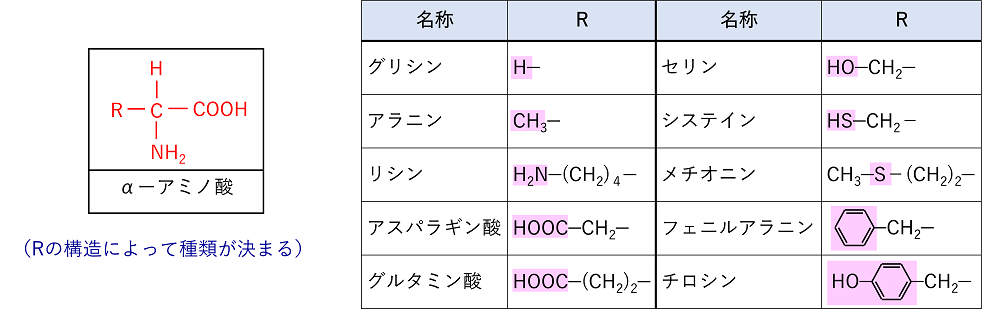
分子中に〔 アミノ基 〕-NH2と〔 カルボキシ基 〕-COOHをもった化合物をアミノ酸といい,この2つの官能基が,同一の炭素原子に結合しているものを〔 α−アミノ酸 〕という(左下図))。α−アミノ酸の種類はのRの構造によって決まる。
|
 |
|
リシンはRにNH2をもつので,〔 塩基性アミノ酸 〕,アスパラギン酸とグルタミン酸はRにCOOHをもつので〔 酸性アミノ酸 〕という。これらのアミノ酸のうち体内で合成されないものは外部から摂取する必要があり,必須アミノ酸と呼ばれる。また,グリシン以外は不斉炭素原子があるため光学異性体が存在する。
【アミノ酸の構造と性質】
アミノ酸の検出反応
アミノ酸の水溶液に〔 ニンヒドリン 〕水溶液を加えて温めると,〔 アミノ基 〕と反応して赤紫〜青紫色を呈する。これは〔 ニンヒドリン反応 〕とよばれ,アミノ酸の検出・定量,タンパク質の遊離アミノ基の検出に用いられる。
アミノ酸の反応
アミノ酸のカルボキシ基は〔 アルコール 〕とエステルを生じ,アミノ基は〔 無水酢酸 〕と反応してアミドを生じる。
|
 |
|
光学異性体
グリシン以外はすべて〔 不斉炭素原子 〕をもつため〔 光学異性体 〕が存在する。またα-アミノ酸の光学異性体の表し方にはD型,L型がある。不斉炭素原子を中心に水素原子を奥に置いたときに,COOH,R,NH2の配置が時計周りならD型,反時計周りならL型としている。天然のアミノ酸はL型の構造をもっている。
|
 |
|
双性イオンと等電点
アミノ酸はアミノ基-NH2とカルボキシ基-COOHがあるので,酸と塩基の両方の性質を示す両性化合物である。そのため,カルボキシ基はH+を放出して−COO−となり,アミノ基はH+を放出して−NH3+となる。このように分子内に分子内に正負両電荷が存在するイオンを〔 双性イオン 〕という(分子内塩ということもある)。アミノ酸の結晶は双生イオンがクーロン力で結合したイオン結晶となる。アミノ酸の結晶は双生イオンがクーロン力で結合したイオン結晶となる。
アミノ酸の水溶液はpHによって,双性イオン,陰イオン,陽イオンが平衡状態になる。また,これらの平衡混合物の電荷が0となっているときのpHを〔 等電点 〕という。等電点では双性イオンの状態がほとんどで,水溶液のpHを等電点以上にすると,陰イオンに,pHを等電点以下にすると陽イオンになる。
|
 |
|
酸性アミノ酸の等電点は小さく,塩基性アミノ酸の等電点は大きい。
酸性アミノ酸は〔 −COO− 〕が多いので,±0の状態にするにはよりH+を要するので等電点は〔 小さく 〕なる。
塩基性アミノ酸は〔 −NH3+ 〕が多いので,±0の状態にするにはよりOH−を要するので等電点は〔 大きく 〕なる。
|
|
例題
グルタミン酸(等電点3.2),アラニン(等電点6.0),リシン(等電点9.7)の混合水溶液中の各アミノ酸を,電気泳動によって分離することを試みた。
図の〈実験装置〉のように,pH6の緩衝液を染み込ませたろ紙の中央にアミノ酸の混合水溶液を染み込ませた糸をのせ,直流電源を接続して電気泳動を行った。その後,糸を取り,ろ紙をアミノ酸指示薬で呈色させたところ,図の〈結果〉のように,3本の(a)〜(c)としてアミノ酸の分離が確認できた。(a)〜(c)にはそれぞれどのアミノ酸が含まれるか。 |
 |
|
|
pH6は,グルタミン酸にとっては等電点以上,アラニンにとっては等電点,リシンにとっては等電点以下になる。そのため,pH6の緩衝液では,グルタミン酸は陰イオン,アラニンは双性イオン,リシンは陽イオンになる。よって,電気泳動を行うと,陰極側(a)にリシン,中央(b)にアラニン,陽極側(c)にグルタミン酸が検出される。
|
 |